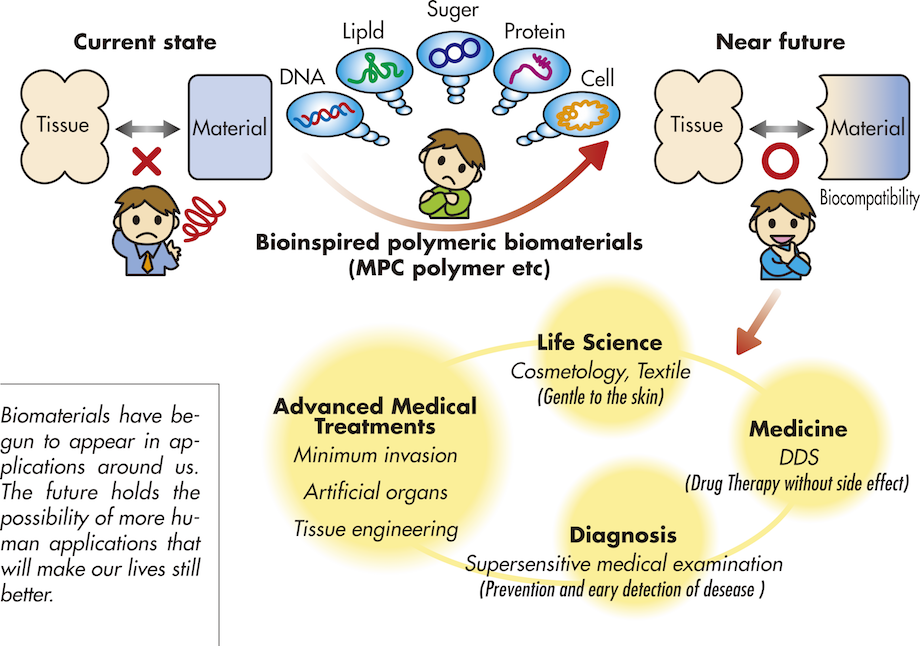
生体に倣うマテリアルデザイン
医療技術の発展にマテリアルサイエンスが重要な役割を果たしてきたことは言うまでもありません.柔軟かつ耐久性の高いカテーテル,形状記憶特性を活かした自己拡張性ステント,複雑な形態の骨欠損の修復を可能にする自己硬化性骨ペースト,酸素透過性に優れたコンタクトレンズ,自己会合性を利用した薬物輸送用ナノ粒子,組織再生用細胞シートを調製するための温度応答性培養皿など,医療分野で必要とされるマテリアルの形態は様々です.生体と接触して用いられるマテリアルには,個々の用途に適したバルク特性を備えていることはもちろんのこと,生体と安定な界面を形成することも要求されます.なぜなら,人工的に作られたマテリアルは,もともと生体に存在していない構造を持つため,生体はいち早くこれを認識し,排除しようとします.この応答は生体にとってごく自然かつ重要なものです.しかし,人工のマテリアルを用いた治療ではマテリアルに対する生態の応答が障壁となることがあります.
生体材料学研究室では生体とマテリアルとの界面の設計に焦点をおき,生体から異物として認識されないポリマーマテリアルの開発を行なっています.具体的には細胞膜を構成するリン脂質の構造を模倣した双性イオン型ポリマー(MPCポリマー)や核酸の構造に倣った生分解性ポリマー(ポリリン酸エステル)を主軸とし、新たなポリマー分子設計および精密合成、さらに、メディカルデバイス、組織工学、DDSなどへの応用研究も展開しています.
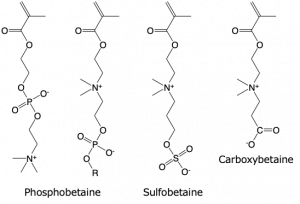
双性イオン型ポリマー
双性イオン型分子とは,同一分子内に近接したカチオンとアニオンの両方をもち,これらが完全にイオン化している状態にある分子を指します。図Bに代表的な双性イオン型ビニルモノマーの構造を示します.
双性イオン型ポリマーに共通して認められる生体分子の非吸着特性(ノンファウリング性(図C))は双性イオン基の水和と表面電荷によるものと考えられています.双性イオンの高い水和能力によってポリマー近傍に存在する多くの水分子が生体分子とポリマーとの相互作用を妨げます.また,双性イオンは水媒体中においても,極性基内で塩を形成(環化)したり,隣接する極性基間や分子間で相互作用することによって表面電位がほぼ中性になります.その結果,生体分子と双性イオン型ポリマーとの間でイオン性相互作用が生じ難くなります.双性イオン型ポリマーのバイオマテリアル応用は90年代から本格的に始まりました.これは、細胞膜の形態に想起されたものです.細胞膜はリン脂質二分子膜にタンパク質が埋め込まれ,その表面は糖鎖で覆われています.糖鎖やタンパク質は細胞の分子認識や物質輸送を担っています.一方、リン脂質は糖鎖やタンパク質が円滑に機能する場を提供しています.このことからも細胞の表面を模倣することにより生体分子との非特異的な相互作用を抑制できるが期待されます.リン脂質には,ホスファチジルコリン以外にホスファチジルセリンやホスファチジルエタノールアミンが存在しますが,生きた細胞の外膜には中性のホスファチジルコリンが高い組成で存在することが知られています.
ポリリン酸エステル
ポリリン酸エステル(図D)は核酸に類似した主鎖構造をもち,生体内で酵素的,非酵素的に分解するため,薬物担体や組織工学足場材料への応用が検討されています.過去,米国においてポリリン酸エステル製の薬物徐放担体(Paclimer®)の第1相臨床試験が実施され,原発性腹膜癌および卵巣癌の患者の生体内で8週間にわたるパクリタキセルの徐放が可能になることが示されました.しかし,開発企業がそれ以降の臨床研究を休止したため,ポリリン酸エステルの臨床応用は,いまだ達成されていません.当時はポリリン酸エステルが単なる生分解性ポリマーとして捉えられ,他の製剤との差異が明確に示されなかったことが臨床研究の休止に繋がった理由のひとつと考えられます.一方,ここ数年でポリリン酸エステルの合成法は格段に進歩し,ポリリン酸エステルが生分解性以外に興味深い特徴を示すことが明らかとなりました.我々は重合触媒として含窒素複素環化合物(以下,有機触媒とする)を用いたポリリン酸エステルの精密合成を世界に先駆けて実施し,分子量分布の極めて狭いポリマーの獲得に成功しました.この重合法は自己反応性の金属触媒を使用しない安全かつ汎用的な合成手法として国内外のさまざまな研究グループにより再現されています.ポリリン酸エステルは,典型的な生分解性ポリマーとされる脂肪族ポリエステルに比べ,側鎖の化学構造やトポロジーを簡便に制御でき,その結果,溶解性や会合性の制御,さらには薬物や蛍光分子などの機能分子との複合化も可能です.
.
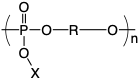
図D.ポリリン酸エステルの構造
