Research topics
[ 研 究 テ ー マ ]
1
スマートバイオマテリアルの医用材料としての応用
温度やpHなどの外部環境や刺激に対して、応答する材料はスマートマテリアルと呼ばれ,そのうち医療に応用を意図したものが「スマートバイオマテリアル」です。当研究室では、温度刺激に対して、ゾル(溶液)からゲルへ転移したり、形状を変えたりする生分解性ポリマーを用いたスマートバイオマテリアルによる新しい治療システムを開発しています。
1-1.生分解性インジェクタブルポリマー
室温ではゾル(コロイド溶液)状態で、体温でゲル化するポリマー溶液は、注射器などで簡単に体内へ注入でき,打ち込んだその場でゲル化するため,インジェクタブル(=注射可能)ポリマー(IP)としての医療応用が期待されています。 私たちはそれらの中でも,ポリ(カプロラクトン-グリコール酸)(PCGA)とポリエチレングリコール(PEG)からなるトリブロック共重合体(PCGA-b-PEG-b-PCGA)を基盤ポリマーとして,温度応答型IPの研究を展開しています。このポリマーは生体内で無害な成分として代謝・吸収されるため,生体内でその役割を果たした後に取り出す必要がなく,安全性に優れています。また,乾燥状態で粉末であるため,取り扱いが容易であるという利点があります。 従来の生分解性IPでは、ゲル化後に体内で長期間ゲル状態を維持できないなどの問題がありました。私たちは,ゲル化と同時にゲル内部で共有結合による架橋反応が進行する新しいIPシステムを開発することに成功しました。このIPシステムで作成したゲルは,体内で長期間ゲル状態が維持できるだけでなく,ポリマー溶液の配合比を変えるという実に簡便な手法で,体内での分解時間やゲルの強度を調節できます。 現在は以下の目的でのこのIPシステムの応用を検討しています。
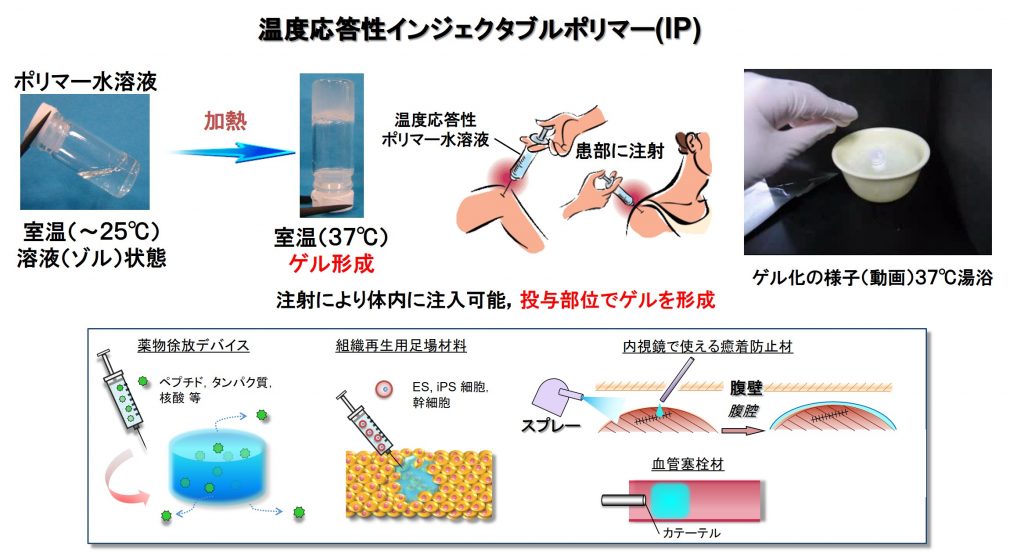
IPゲルを用いた薬物徐放型ドラッグデリバリーシステム(DDS)
体内のどこかに薬物を溜めた場所(リザーバー)を作成し,そこから薬を少しずつ放出するのが徐放型DDSです。我々の開発IPは,水溶性,脂溶性の薬剤どちらも内包させることが可能であり,体内(腹腔,皮下)に注入した薬物内包IPゲルから,分解・拡散により薬を徐放することが可能です。これにより,体内の薬物濃度を長時間有効濃度に保つことにより,低侵襲に治療効果を向上させます。
内視鏡・腹腔鏡手術時に使用可能なゲル状癒着防止材
外科手術後に腹膜内部や臓器がくっついてしまう「癒着」が頻発します。現在,臨床現場では膜状の癒着防止材が使用されていますが,使い勝手は良くありません。また,最近では,手術時に開腹部を大きくとらず,小さ開けた穴から内視鏡・腹腔鏡を挿入して手術する腹腔鏡手術が増えていますが,この術式では膜状の癒着防止材は使えません。IPは細い管(カテーテル)から容易に吐出でき,こうした術式でも患部周囲をゲル状の膜で覆うことができます。私たちは分解時間を制御可能なIPを癒着防止材として応用する研究をしています。
各種細胞・幹細胞を封入したIPゲルによる細胞デリバリー治療および再生医療
軽い傷ならば生体自身の回復能で治癒しますが,大きな損傷となると自身では回復不可能です。怪我や病気,先天的異常などで回復不可能なほどに損傷・欠損した臓器・組織を,人工的に再生させる技術が再生医療です。開発したIPゲル中に細胞を封入しておくと,ゲルが足場となって細胞の増殖や分化が進み,組織が再生できる可能性があります。また,幹細胞は自身が多様な細胞に分化するだけでなく,サイトカインと呼ばれる生理活性物質を放出することで,周囲の組織の治癒・再生を促します。ゲル中に幹細胞を入れて注入すると,幹細胞が患部に留まるため,治癒・再生の促進効果を高めることが可能になると考えています。
IPゲルによる血管塞栓療法
治療を目的として血管などを意図的に詰まらせることを「塞栓療法」といいます。カテーテル治療で誤って破損した血管を,血流を一次的に塞栓・止血して治療したり,癌組織の上流の血管を塞栓して死滅させたり,病的な不要血管を塞栓して疼痛を抑えたりするなどの治療法が考案されています。我々のIPゲルは分解時間の制御が容易で再開通も可能なことから,これらの塞栓療法にも威力を発揮すると考えています。
1-2.生分解性形状記憶ポリマー
「形状記憶ポリマー」とは,温度を上昇させると,「記憶」していた「かたち」を思い出し,形態変化するポリマーを指します。私たちは,生分解性で鋭敏な温度応答性形状回復能を示す形状記憶ポリマーの合成にも成功しています。こうした形状記憶ポリマーを利用することにより,新しい治療方法やデバイスの開発ができるのではないかと考えています。
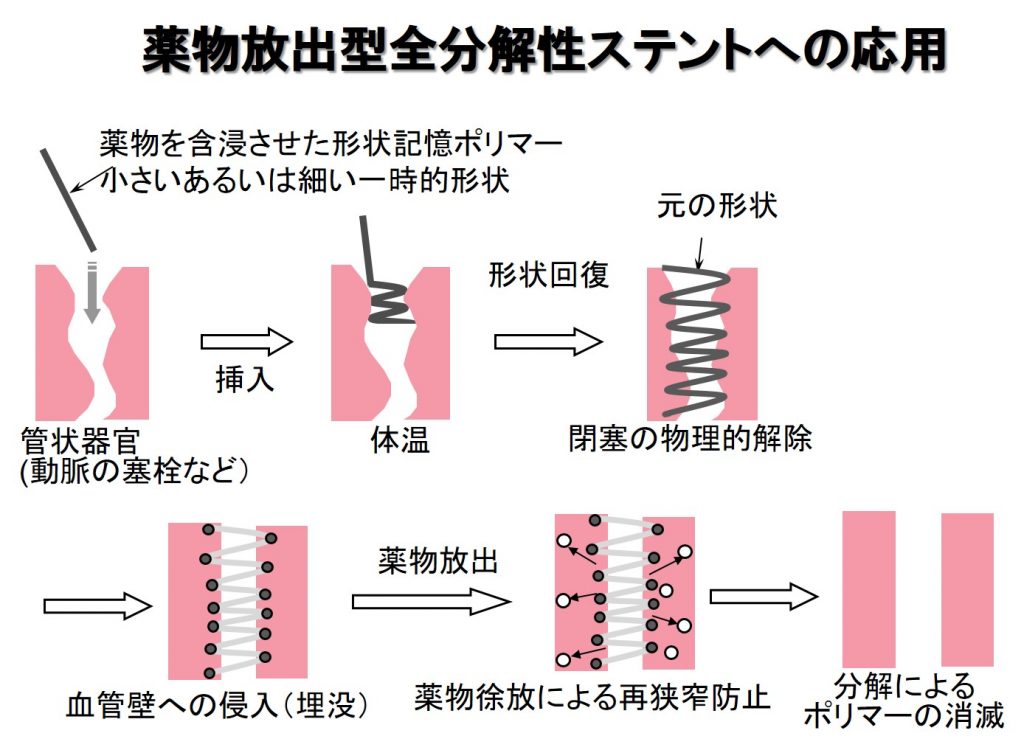
全分解性ステント
血管など管状の臓器が目詰まりを起こす症状を「狭窄」と言います。ステントは狭窄部位を押し広げて流れを回復させる円筒網状の治療器具です。現在のステントはほぼ全て金属製で,分解性を有しておらず,抜去(取り除くこと)が難しいため,同じ場所が再狭窄した場合にもう一度留置することができません。このため,生分解性ポリマー製の全分解ステントが開発されつつあります。私たちは,自己拡張型の全分解性ステントの素材として,我々が開発した生分解性形状記憶ポリマーを使用する試みを続けています。
2
ナノ粒子によるドラッグデリバリーシステム(DDS)
微粒子や水溶性高分子をキャリヤー(運び手)として,薬物を体内の効いてほしい場所に送り届ける製剤技術をターゲティング(標的指向化)といいます。私たちは,長年にわたって水溶性高分子を用いた高分子プロドラッグによるDDSの研究を進めてきました。最近では,高分子ミセルやナノゲルなどのナノサイズの微粒子(ナノ粒子)を用いたDDSにも力を入れています。
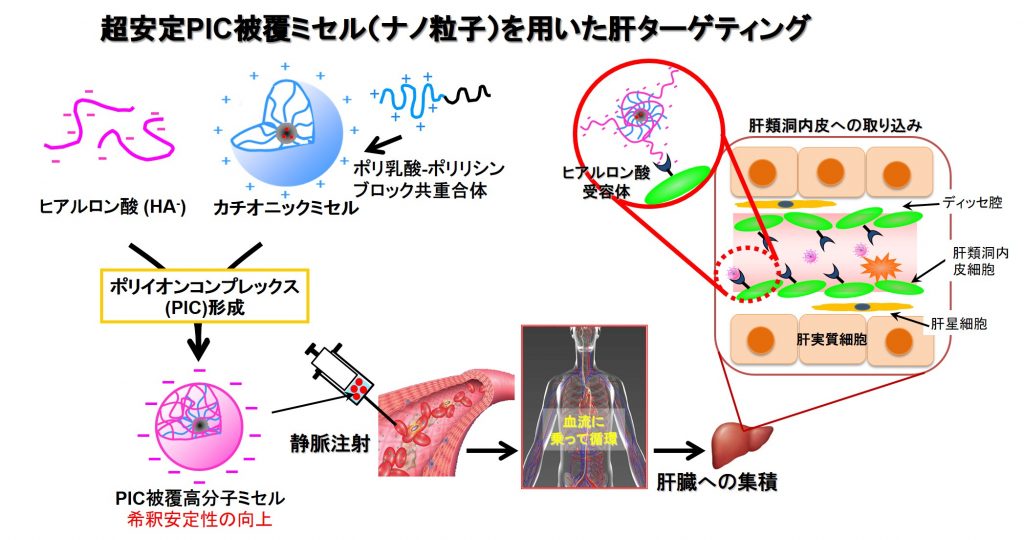
2-1.PIC被覆高分子ミセル
高分子ミセルによるDDSは世界中で研究されていますが,私たちの開発した高分子ミセルは高密度に荷電したシェル(外殻)層を持つことが特徴で,それを利用して反対電荷を持つ高分子電解質(荷電ポリマー)とのポリイオンコンプレックス(PIC)形成により被覆したPICミセルは,通常の高分子ミセルよりも極めて高い安定性を有しています。さらに,被覆させる高分子電解質の性質により,体内の特定の部位に集積させることも可能であると考えています。現在は,肝臓内の特定細胞へのデリバリーなどを想定したヒアルロン酸被覆ミセルを研究しています。
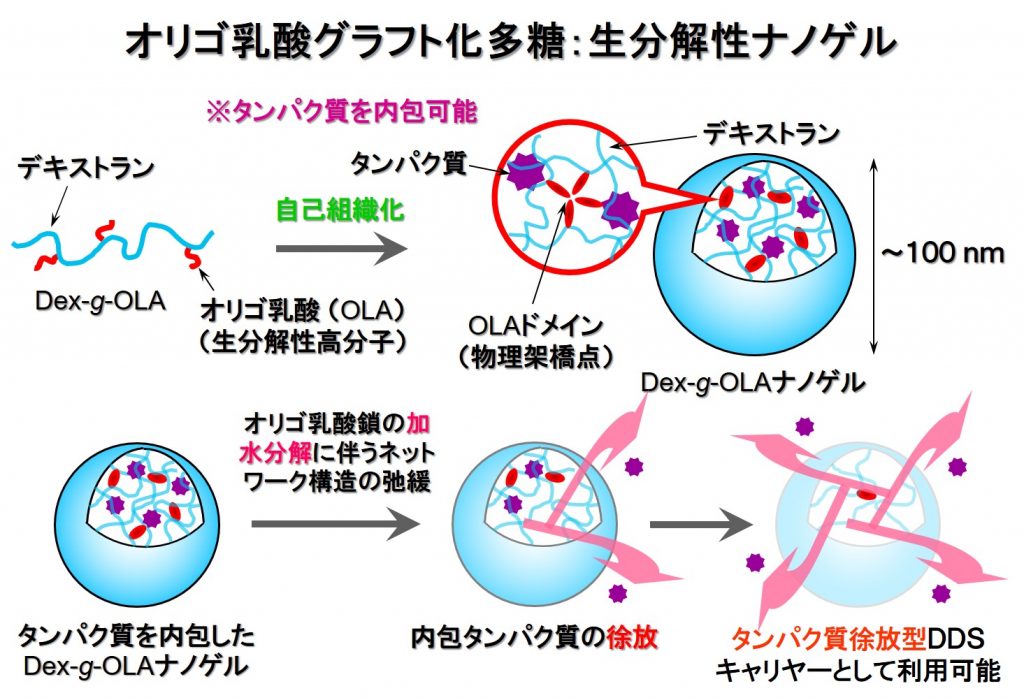
2-2.生分解性ナノゲル
多糖などの親水性高分子に少量の疎水基や疎水グラフト鎖を導入したポリマーは水溶液中で会合してナノサイズのゲル状微粒子(ナノゲル)を形成します。このナノゲルは,高分子ミセルが疎水性薬物の内包にのみ適しているのに対し,疎水性薬物と親水性薬物(タンパク質のような高分子化合物も)の両方を内包できる特徴があります。私たちは,デキストランなどの多糖に疎水性の短いポリ乳酸鎖をグラフト化させた共重合体が生分解性ナノゲルを形成することを見出し,これを用いたDDSについても検討しています。
3
新規な生分解性高分子の合成
当研究室は機能性高分子研究室という名前が示す通り,なにかしらの「機能」,特に生体との相互作用における機能,を持つ高分子を合成することを目標としています。既存の生分解性高分子を組み合わせて,あるいは全く新しい生分解性高分子を生み出し,これまでになかった機能を持つ生分解性バイオマテリアルを創出します。
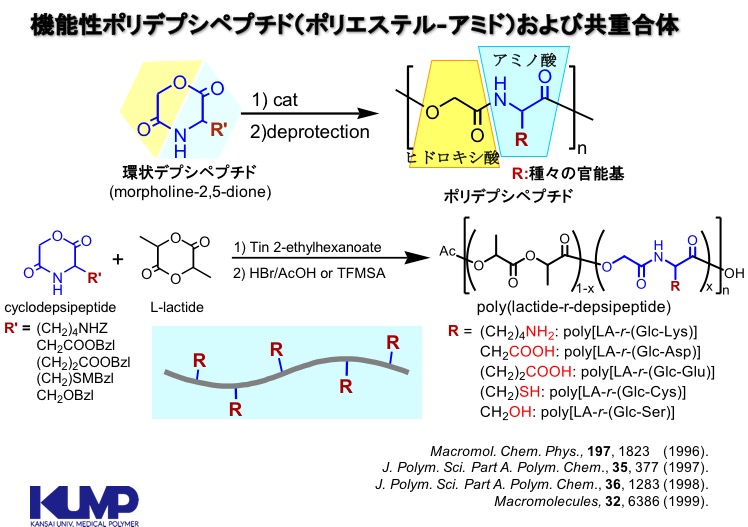
3-1.ポリデプシペプチド
上述した,ポリ乳酸,ポリグリコール酸,ポリカプロラクトンおよびそれらの共重合体などの脂肪族ポリエステルは,生分解性ポリマーとしての実績がある一方で,側鎖に官能基を有しておらず,それ以上の機能拡張が難しいという側面もあります。ポリデプシペプチドとは,タンパク質の構成要素であるα-アミノ酸とヒドロキシ酸の共重合体の総称であり,化学的にはポリ(エステル-アミド)共重合体です。私たちは,アミノ酸1つとヒドロキシ酸1つからなる環状デプシペプチドをモノマーとして重合し,ポリデプシペプチドおよびそれらと脂肪族ポリエステルとの共重合体を合成してきました。アミノ酸には側鎖に様々な官能基を持つものがあり,これを利用することで,脂肪族ポリエステルに官能基を導入することができます。そして,その導入した官能基を化学修飾することで,様々な機能を付与することが可能となります。
3-2.多種多様な共重合体
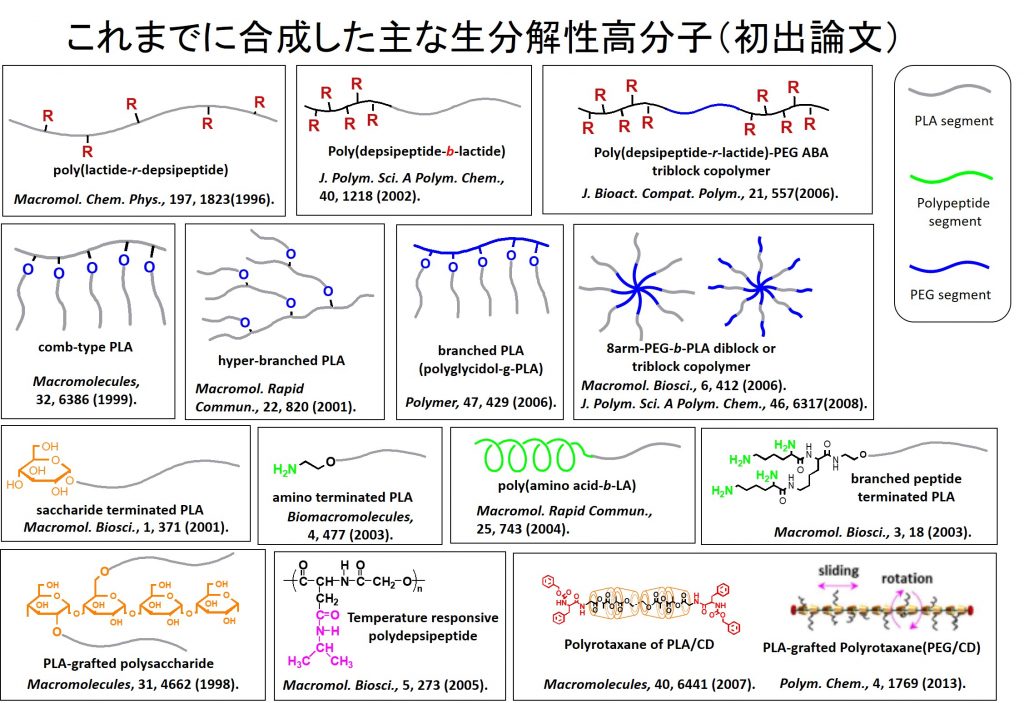
高分子(ポリマー)は直鎖状(線状)で均一な鎖を持つもの(=ホモポリマー)だけではありません。重合技術を駆使することにより,様々な形態を持つ高分子が合成できます。こうしたポリマーの構造は,ポリマー材料の物性や機能と結びついています。 私たちはこれまでに,様々な形態の生分解性ポリマーとして,下に示したような,末端機能化ポリマー,ランダムコポリマー,ブロックコポリマー,グラフトコポリマー,星形ポリマー,ハイパーブランチポリマー,超分子ポリマー(ポリロタキサン,ポリロタキサングラフトコポリマー)などを合成し,その機能と性質について報告しています。