1. はじめに
生命活動における化学反応の多くには酵素が関与しており,特定の物質(基質)を触媒的に変換している。この酵素反応を効率よく行うには,多くの物質の中から必要とされる基質を選別する必要があり,分子の形を特定して反応に必要な基質か判別している。このはたらきを分子認識といい,さまざまな分子間にはたらく力(分子間相互作用)を用いて,必要な分子を選別している。分子間相互作用は生命活動においてだけではなく,化学反応の精密性を高めたり,いわゆる「分子マシン」の駆動力として利用されたりしており1),これからますますその重要性が増すものと考えられる。
2. 分子間相互作用 -非共有結合性相互作用-
分子間相互作用には,静電的相互作用,水素結合,芳香環相互作用,ファンデルワールス力などがあり(図 1)2),これらは分子を形成する力=共有結合と対比して「非共有結合性相互作用」と呼ばれる。これら非共有結合性相互作用の個々の安定化エネルギーは共有結合に比べて小さいが,分子認識場では複数の非共有結合性相互作用が協奏的にはたらくことで,大きな安定化エネルギーを達成するとともに,共有結合に比べて小さなエネルギーで分子間の相互作用を制御している。溶媒に対する親和性や,相互作用の方向性などが異なる多様な非共有結合性相互作用があるが,ここでは水素結合と芳香環が関与する相互作用について取り上げる。
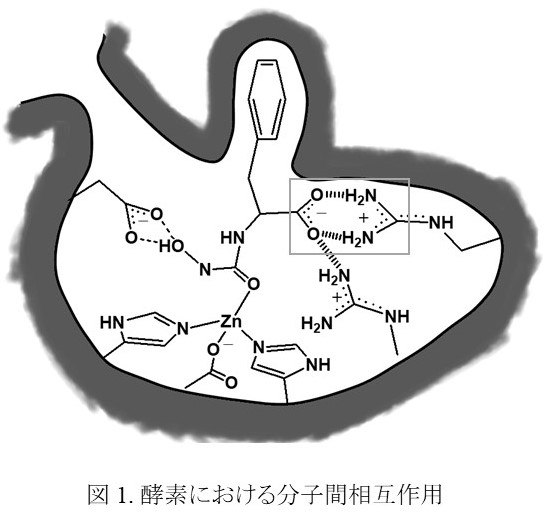
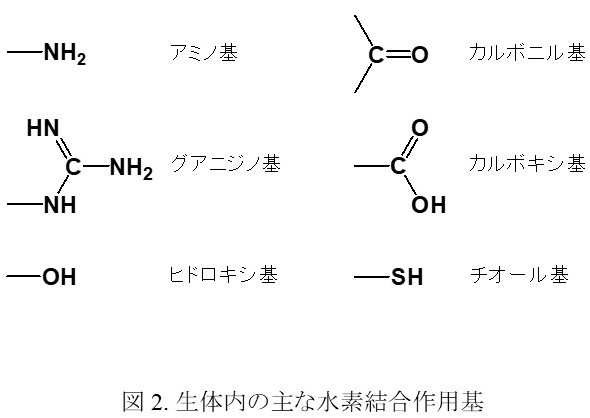
水素結合は,1) 相互作用の安定化エネルギーが比較的大きい 2) 相互作用に方向性があるなどから,生体中における分子認識や酵素反応の調整部位としてよく用いられている。また,相互作用基が生理的 pHに近い酸解離定数(pKa)を示すものが多くあり,相互作用近傍の pHを変化させることによる水素結合の生成・解消が可能であることも,生体内での分子認識に用いられる一因と考えられる。生体分子の多くは C, H, N, O, S原子などから構成される有機分子であり,アミノ基,グアニジノ基,ヒドロキシ基,カルボニル基,カルボキシ基,チオール基などが水素結合の相互作用基として知られている(図 2)。なかでも,アミン基やグアニジノ基がプロトン化したアンモニウムあるいはグアニジニウム部位と,カルボキシ基が脱プロトン化したカルボキシレート部位の間の相互作用は,アンモニウム,グアニジニウムにある正電荷とカルボキシレートの負電荷間にはたらく静電的相互作用と,N-H結合とカルボキシレートの酸素原子間にはたらく水素結合が同時にはたらき,静電的相互作用による大きな分子間相互作用の安定性と,水素結合による方向選択性が得られることから,多くの分子認識場に見受けられる(例えば図 1の囲み)。
一方,芳香環が関与する相互作用もいくつかの分子認識場においてその役割を果たしており3),芳香環を有する物質を識別するのに力を発揮すると考えられるが,その他の非共有結合性相互作用に比べるとその作用原理はそれほど研究されてはいない。
3. キラリティと光学分割
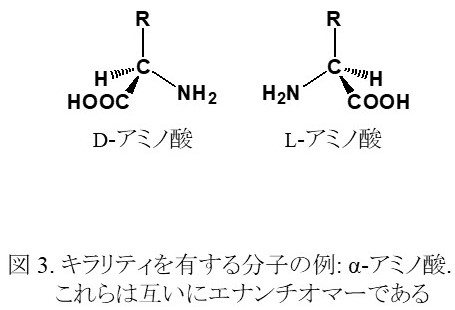
キラリティを有する分子には,その立体異性体としてエナンチオマーがあり(図 3),これら二つの異性体分子は,偏光に対する性質を除いて物理的化学的性質が同じであることから区別することが難しい。しかし,これらの異性体間では生体に対する作用が異なることが知られており,例えば一方の異性体が薬などのように体に有用に用いられることがあるのに対して,他方の異性体は毒性を示すといった物質もある。したがって,薬などの生体に用いるものの原料とする場合,必要な一方の異性体を純度良く得る必要がある。一般に,キラリティを考慮せずにアミノ酸や糖などといったキラリティを有する化合物を合成した場合は,エナンチオマーどうしが当量混ざったラセミ体が得られる。ラセミ体から一方の光学異性体のみを取り出す方法は「光学分割」と言われ,必要な光学活性体を得る方法としてよく用いられる。
光学分割剤を用いる方法は光学分割でもっともよく用いられる。これは光学異性体の混合物であるラセミ体の酸(あるいは塩基)に,キラリティが決まっている塩基(あるいは酸)を作用させて酸塩基反応を用いてジアスレテオマー塩へと誘導し,ジアステレオマー間の性質の違い(特に溶解度の違い)を用いて分離を行う方法である(図 4)。一般的に,ジアステレオマー塩のうち溶解性が小さい難溶性塩の方が光学純度は高くなるので,反応液中に生じる結晶をろ過によって集め,必要であれば再結晶を行い,そこから高純度の光学活性体を得ることが可能である。
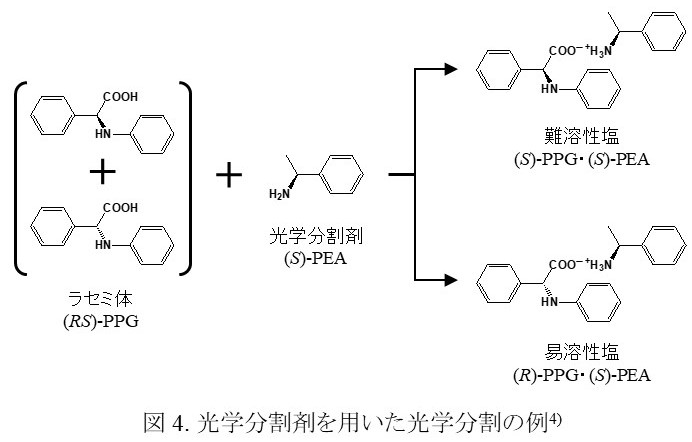
ここで,二つのジアステレオマー塩(難溶性塩と易溶性塩)について考えてみる。ジアステレオマー塩は,塩基性物質がプロトン化した陽イオンと酸性物質が脱プロトン化した陰イオンから構成されており,イオン間の静電的な引力が塩を形成する大きな力となっている。したがって塩の溶解性はこのイオン間の力に大きく影響を受け,難溶性塩では易溶性塩よりもイオン間の引力が強いために溶媒に溶けだしにくくなっていると考えられる。しかし二つのジアステレオマー塩では,塩を構成している各イオンは立体配置以外同じであり,イオン間にはたらく静電的な力にはそれほど大きな違いがあるとは思われない。
4. 立体選択における水素結合の重要性
酸塩基反応を用いた光学分割に用いられる塩基性光学分割剤,あるいは光学分割に供する塩基性物質は,ジアステレオマー塩としたときにプロトン化され陽イオンとなる必要があるため,その多くはプロトン化を受けやすいアミン類であることが多い。アミン類がプロトン化することによる生成する有機アンモニウムイオンは,窒素原子に 1~3個の炭素原子と1~3個の水素原子が結合した四面体型構造を取り,N-H結合は窒素原子と水素原子の電気陰性度の違いとアンモニウム上に存在する正電荷のために,水素結合(と静電的相互作用)を形成しやすい状態にある。結晶中においては,ほぼすべての N-H結合は水素結合していると考えられる。結晶の対称性と分子の立体配置を考えると N-Hの水素結合の先に有る原子団はすべて異なることが予想されるので,窒素に結合した炭素鎖が異なればアンモニウム基の窒素原子は結晶中において疑似的に光学活性中心としてふるまうと考えてよい。
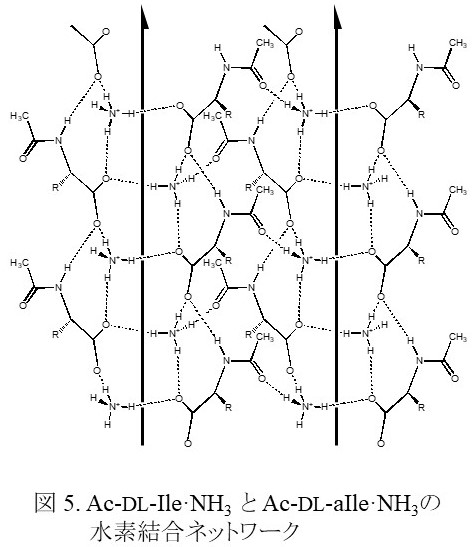
同様なことは,無置換アンモニウム(NH4+)塩の結晶中でも観測されている。α-アミノ酸である DL-イソロイシンは光学異性体である D-体と L-体が等量混合されたラセミ体である。アミノ酸のアミノ基をアセチル基で保護することにより酸性物質となり,さらにアンモニアを作用させるとアンモニウム塩(Ac-DL-aIle NH3)となる。Ac-DL-aIle NH3は,その過飽和溶液に種晶として少量の Ac-L-aIle NH3を加えると加えた量以上の Ac-L-aIle NH3が析出し,光学分割剤が無くても光学分割することができる(このような光学分割法を,優先晶出法という) 5)。 一方で,Ac-DL-aIle NH3の結晶においては,Ac-DL-aIle陰イオンとアンモニウムイオンが複数の水素結合によってらせんを形成するように配置されており,一つのらせん内では一方の光学異性体のみ含まれている(図 5)。アンモニウムイオンそのものは等価な四つの N-H結合を持ちキラリティを持たないが,Ac-DL-aIle NH3の結晶中ではそれぞれの N-H結合がAc-DL-aIle陰イオンの異なった部位に水素結合しており,このことによりこの結晶中においてはアンモニウムイオンの窒素原子にはキラリティがあるとみなすことができる。このことは,このアンモニウムイオンと Ac-aIle陰イオン間の水素結合により生じるキラリティにより,Ac-aIle陰イオンのキラリティを識別していると考えることができる。
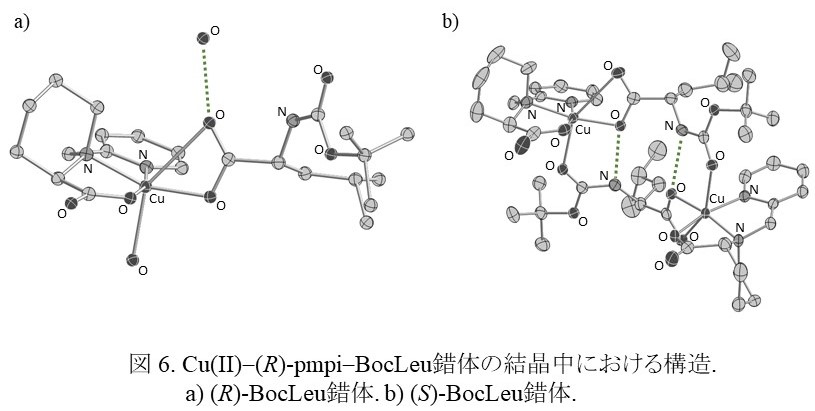
立体選択における水素結合の重要性は,金属錯体を利用したアミノ酸誘導体の光学分割でも見出されている6)。(R)-N-(2-ピリジルメチル)ピペコリン酸(pmpi)銅(II)錯体を用いて (RS)-N-(t-ブトキシカルボニル)ロイシン (BocLeu)を光学分割したところ,再結晶溶媒に水-アセトニトリル混合溶媒を用いた時は (R)-BocLeu錯体が,アセトンを用いた時には (S)-BocLeu錯体が結晶として得られた。両錯体の溶媒による溶解度の違いは,結晶中における水素結合ネットワークの違いに起因している。(R)-BocLeu錯体(図 6a)の結晶化には配位水および結晶水が必要であり,水を含まない溶媒(アセトン等)中では結晶を形成しないと考えられるが,(S)-BocLeu錯体(図 6b)は結晶生成に水を必要とせず,配位子間の水素結合と銅(II)への軸配位によって生じた二量体が積層することにより結晶化している。それとは逆に水を含む溶媒中では,(R)-BocLeu錯体では配位水および結晶水の水素結合ネットワークにより結晶化が促進され,(S)-BocLeu錯体では,二量体を形成する銅(II)イオンの軸位への BocLeuの配位を溶媒中の水が阻害するために結晶化しにくいと考えられる。
4. 芳香環(π-π)相互作用
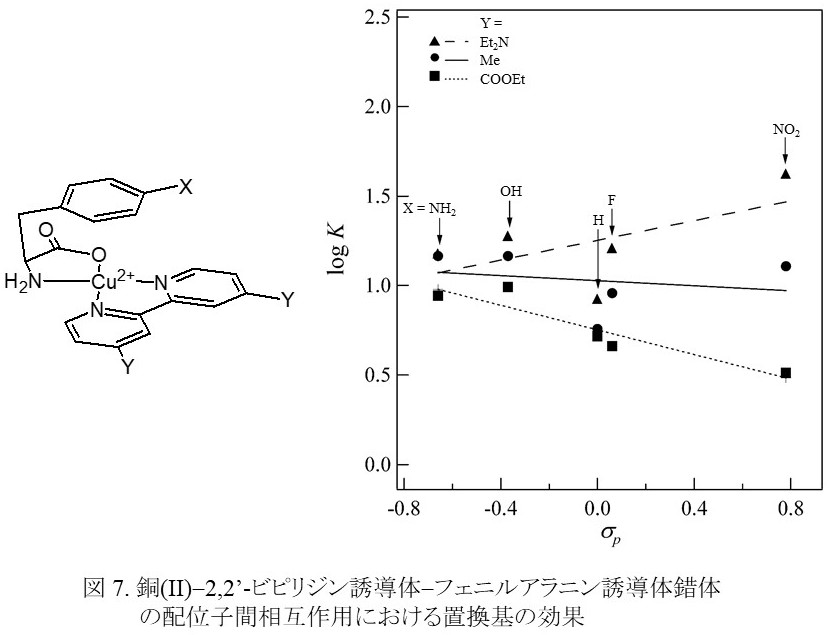
ベンゼン環などの芳香環は,酵素の認識部位や超分子の形成などでお互いが接近している様子がよく見られ,それらは総称して芳香環(π-π)相互作用と呼ばれる。芳香環は,その対称性の高さや構成する水素および炭素原子の電気陰性度がそれほど変わらないことなどから極性が小さく,したがって芳香環相互作用はその芳香環を囲んでいる溶媒などの水素結合に起因する疎水性相互作用の一種と考えられてきた。しかし,相互作用の強度が置換基の電子的な影響を受けることから7),芳香環の電子状態が芳香環相互作用に影響を与えるものと考えられる。このことは,金属錯体を用いた系においても明らかにされており(図 7)8),また白金(Ⅱ)-芳香族イミン錯体と芳香環との相互作用は,エンタルピー的に安定化していることが示されている9)。さらには,π-π相互作用により芳香環上の有機ラジカルが安定化される事例が見つかっており10),物質の反応性の制御へのπ-π相互作用の応用が期待される。
5. まとめ
非共有結合性相互作用から,対照的な水素結合と芳香環相互作用について紹介した。水素結合はその相互作用原理はこれまでによく研究されており,今後はその応用面が大きく取り上げられてくるものと思われる。それに対してπ-π相互作用は,その相互作用原理がよくわかっていない。今後,その原理が明らかになるにつれ,分子認識場あるいは反応の制御に応用されるものと期待される。
(関西大学理工学会誌「理工学と技術」 25巻 25~28ページ (2018年) より一部改変)
参考文献
1) J. F. Stoddart, Angew. Chem. Int. Ed., 2017, 56, 11094とその引用文献.
2) a) F. A. Quiocho, W. N. Lipscomb, Adv. Protein Chem., 1971, 25, 1-78. b) J. H. Cho, D. H. Kim, S. J. Chung, N.-C. Ha, B.-H. Oh, K. Y. Choi, Bioorg. Med. Chem., 2002, 10, 2015-2022.
3) 例えば S. T. Rao, F. Shaffie, C. Yu, K. A. Satyshur, B. J. Stockman, J. L. Markley, M. Sundarlingam, Protein Sci., 1992, 1, 1413-1427.
4) T. Yajima, M. Kitano, T. Shiraiwa, 未発表データ.
5) T. Yajima, M. Kimura, Y. Hori, T. Shiraiwa, Acta Crystallogr., 2016, B72, 650-657.
6) T. Yajima, T. Fukushima, A. Yamada, T. Shiraiwa, Inorg. Chim. Acta, 2017, 466, 451-455.
7) E. A. Meyer, R. K. Castellano, F. Diederrich, Angew. Chem. Int. Ed., 2003, 42, 1210-1250とその引用文献.
8) T. Yajima, R. Takamido, Y. Shimazaki, A. Odani, Y. Nakabayashi, O. Yamauchi, Dalton Trans., 2007, 299-307.
9) T. Yajima, G. Maccarrone, M. Takani, A. Contino, G. Arena, R. Takamido, M. Hanaki, Y. Funahashi, A. Odani, O. Yamauchi, Chem. Eur. J., 2003, 9, 3341-3352.
10) H. Oshita, H. Abe, F. Tani, S. Mori, T. Yajima, Y. Shimazaki, Chem. Eur. J., 2019, 25, 7649-7658.